Titulación de un ácido débil con una base fuerte YouTube

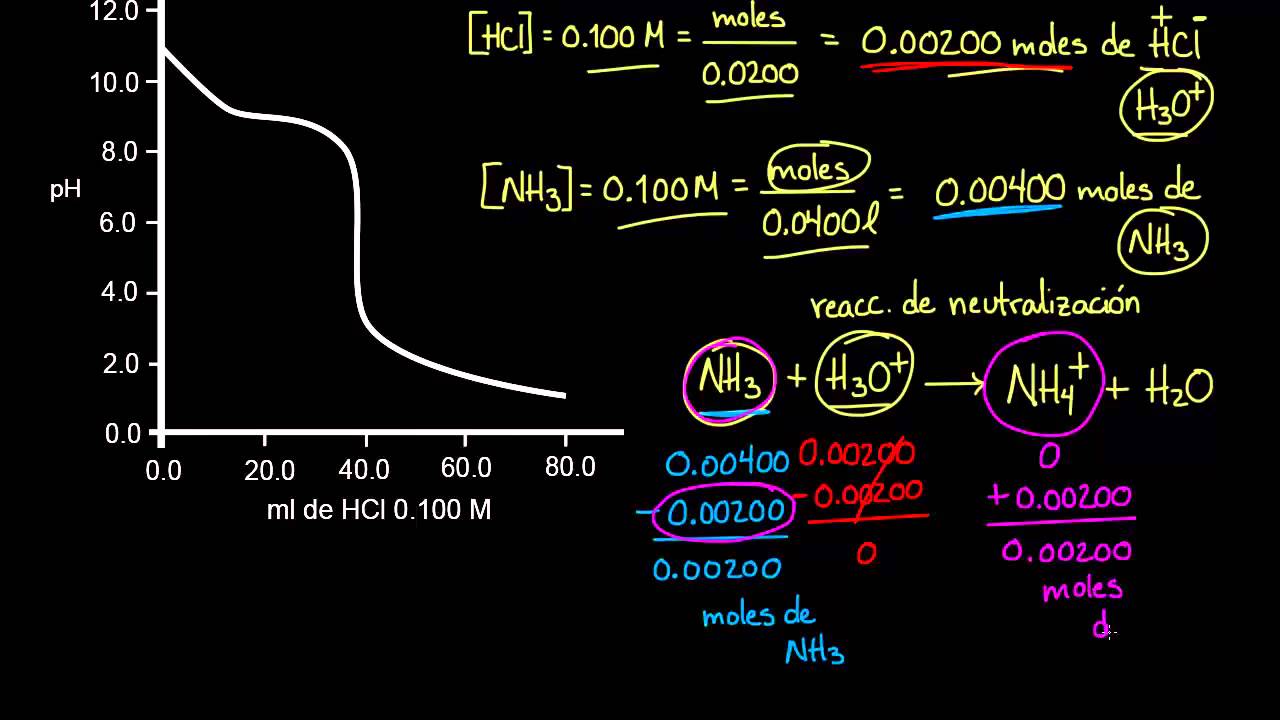
Reacciones base débil-ácido fuerte. Cuando se mezclan una base débil y un ácido fuerte, reaccionan según la siguiente ecuación iónica neta: B (aq) + H₃O⁺ (aq) → HB⁺ (aq) + H₂O (l). Si el ácido y la base son equimolares, el pH de la solución resultante se puede determinar considerando la reacción de equilibrio de HB⁺ con agua.
Ácidos fuertes y débiles. Constante de acidez. Ácidos polipróticos

Así: un ácido y una base son fuertes cuando se ionizan completamente, es decir, en el proceso de ionización se transforman completamente en cationes o iones positivos y en aniones o iones negativos. Por otro lado, un ácido y una base son débiles cuando en el agua se ionizan parcialmente, esto es, en solución habrá una proporción de.
Curva De Titulacion De Acidos Debiles XIli

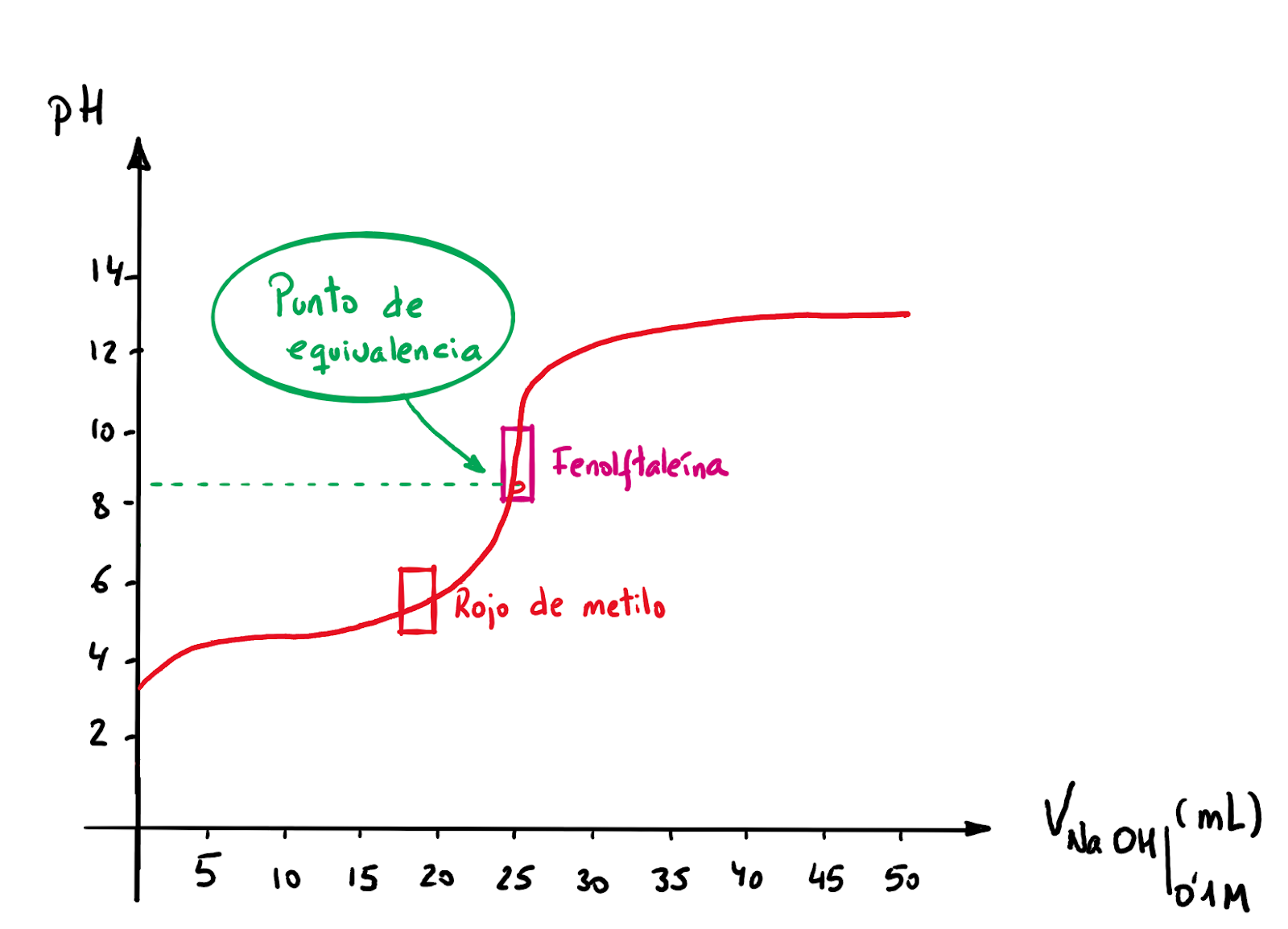
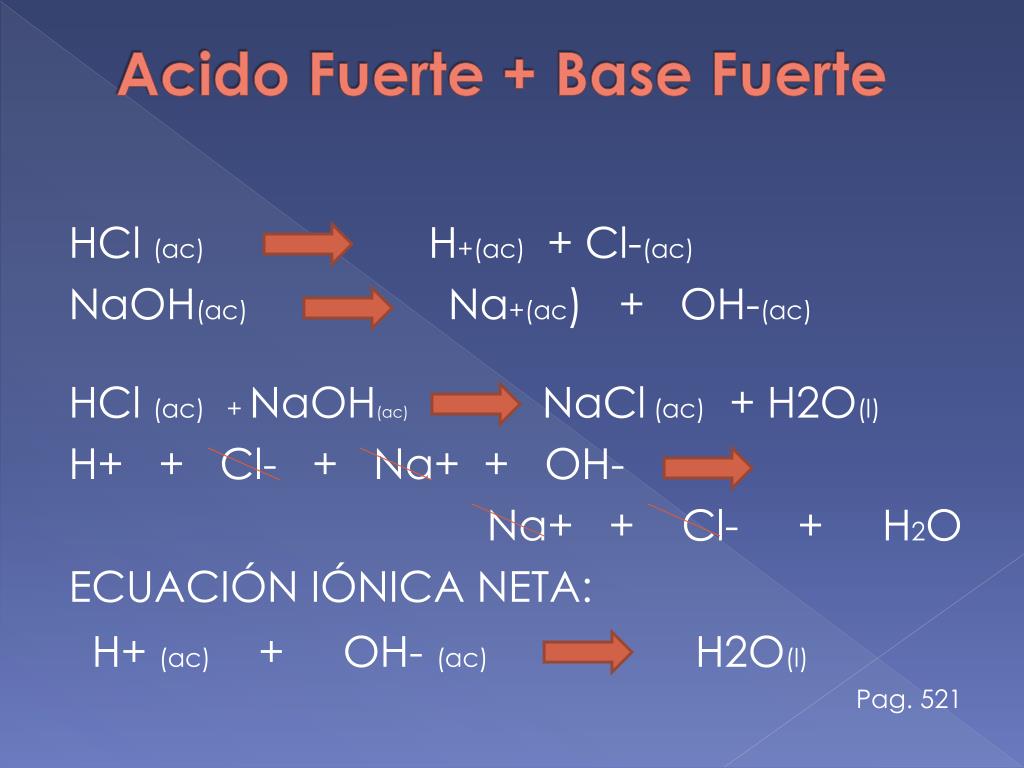
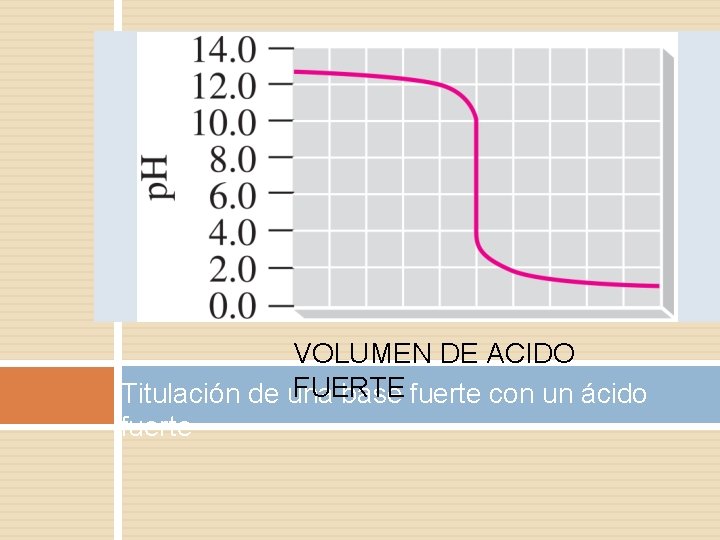
Cálculo del pH de las soluciones de titulación: Ácido fuerte/Base fuerte Se realiza una titulación de 25,00 mL 0,100 M de HCl (ácido fuerte) con 0,100 M de una base fuerte NaOH (la curva de titulación se muestra en la Figura 14.18). Calcule el pH a estos volúmenes de solución de base añadida: (a) 0,00 mL (b) 12,50 mL (c) 25,00 mL (d.
Volumetrías ácidobase. Curvas de valoración Física Química
Base débil. Base fuerte. B. Base fuerte. Mostrar la tabla periódica. Reportar un problema. Aprende gratuitamente sobre matemáticas, arte, programación, economía, física, química, biología, medicina, finanzas, historia y más. Khan Academy es una organización sin fines de lucro, con la misión de proveer una educación gratuita de clase.
PPT REACCIONES DE ACIDOS Y BASES PowerPoint Presentation, free
Para un ácido fuerte como el clorhídrico, su disociación total significa que [HCl] = 0, por lo que la relación de balance de masas en Ecuación 13.3.3 reduce a la expresión trivial C a = [Cl-]. Cualquier ácido para el cual [HA] > 0 es por definición un ácido débil. Del mismo modo, para una base B podemos escribir.
¿Son todos los ácidos y bases igual de fuertes? Clickmica

Los ácidos fuertes y las bases fuertes se refieren a especies que se disocian completamente para formar los iones en solución. Por el contrario, los ácidos y bases débiles se ionizan solo parcialmente y la reacción de ionización es reversible. Así, soluciones de ácidos y bases débiles contienen, en equilibrio dinámico, múltiples especies con carga y sin carga.
酸および塩基の滴定曲線

Reacciones ácido débil-base débil. Cuando se mezclan un ácido débil y una base débil, llegan a un estado de equilibrio representado por la siguiente ecuación: HA (aq) + B (aq) ⇌ A⁻ (aq) + HB⁺ (aq). La posición de equilibrio se encuentra en el lado del ácido más débil y la base más débil, y podemos determinar si la solución.
1 ASPECTOS ADICIONALES DEL EQUILIBRIO ACIDO BASE CONTENIDO
Algunos ácidos fuertes son por ejemplo, el ácido sulfúrico, clorhídrico y nítrico. Siendo bases fuertes, por ejemplo, el hidróxido de sodio y de potasio. Un ácido, cuanta mayor fuerza posea, o tendencia a dar un protón, menor tendencia a captar dicho protón tendrá su base conjugada. Así, cuanto más fuerte sea un ácido, más débil.
Diferencia entre ácidos y bases fuertes y débiles (con ejemplos

Titulaciones de ácido débil-base fuerte. Para la titulación de un ácido débil con una base fuerte, la curva de pH es inicialmente ácida y tiene un punto equivalencia básico (pH > 7). La sección de curva entre el punto inicial y el punto de equivalencia se conoce como región amortiguadora. En el punto de equivalencia media, las.
PPT Acidos , Bases y Electrolitos PowerPoint Presentation ID4710627

Ca (OH) 2. Sr (OH) 2. Ba (OH) 2. El problema es similar con las bases: una base fuerte es una base que está 100% ionizada en solución. Si está menos del 100% ionizado en solución, es una base débil. Hay muy pocas bases fuertes (Cuadro 12.5.1 12.5. 1 ); cualquier base que no figure en la lista es una base débil.
PPT SEMANA 12 ACIDOS, BASES Y ELECTROLITOS PowerPoint Presentation

Un ácido débil es aquel que en disolución acuosa tiene poca capacidad de disociarse en hidrógeno (H+) y en su correspondiente base conjugada. A diferencia de los ácidos fuertes, cuya disociación es completa (100%) y prácticamente irreversible, los ácidos débiles apenas se disocian y de un modo reversible.
PPT REACCIONES DE ACIDOS Y BASES PowerPoint Presentation, free
El ion cloruro es incapaz de aceptar el \(\ce{H^+}\) ion y volverse de \(\ce{HCl}\) nuevo. En general, cuanto más fuerte es el ácido, más débil es su base conjugada. Asimismo, cuanto más débil es el ácido, más fuerte es su base conjugada.
pH Ácidos fuertes y débiles Par ácidobase conjugada YouTube
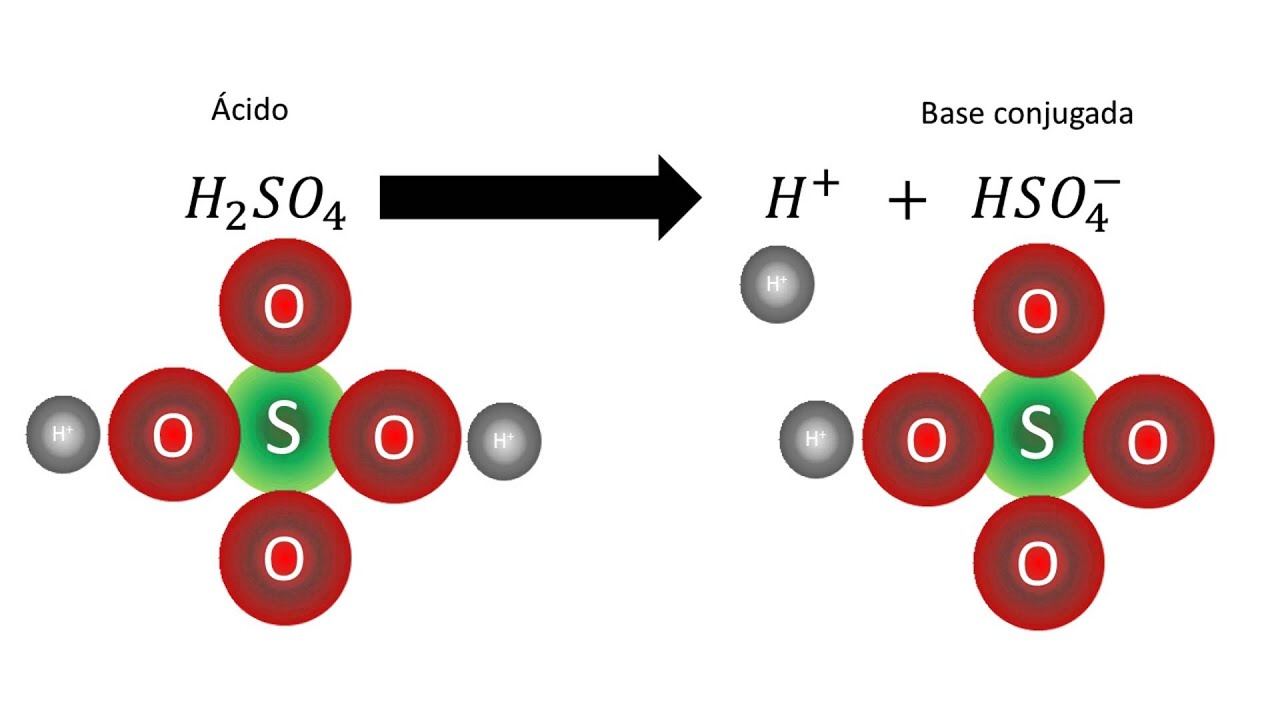
Sin embargo, no todas las bases son iguales. Existen bases fuertes y bases débiles, cada una con características y propiedades especiales. En este artículo, exploraremos las diferencias clave entre una base fuerte y una base débil, y cómo estas diferencias afectan su comportamiento en solución.
Titulación de una base débil con un ácido fuerte Aprendo en Línea
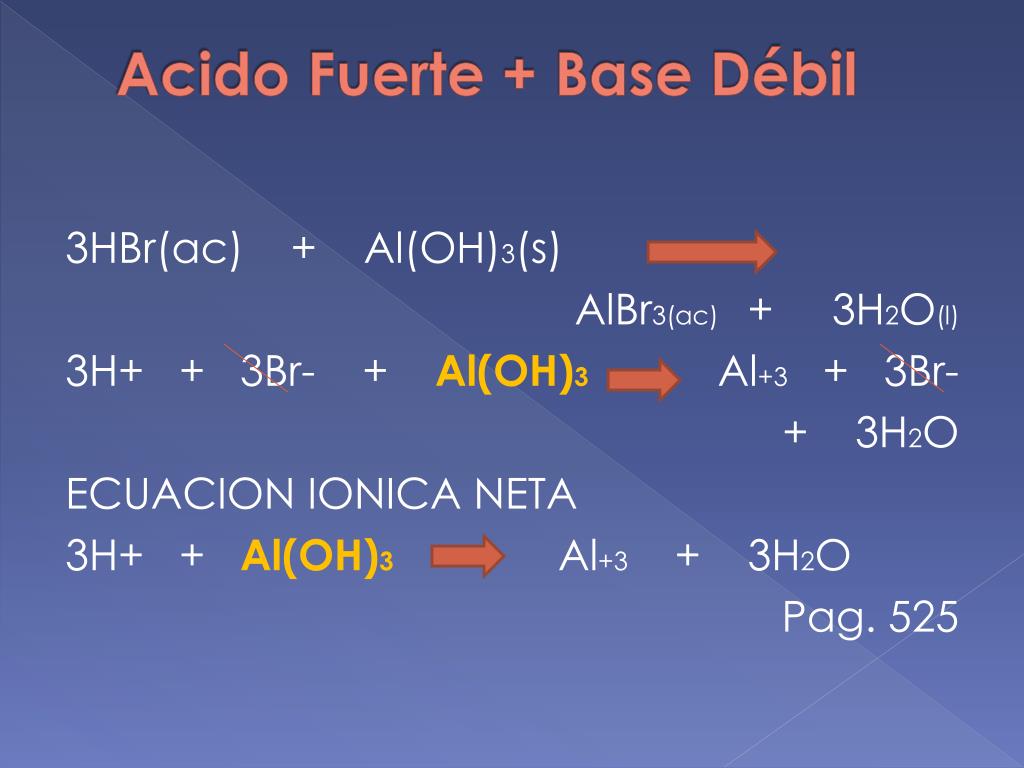
Reacciones ácido débil-base fuerte. Cuando se mezclan un ácido débil y una base fuerte, reaccionan según la siguiente ecuación iónica neta: HA (aq) + OH⁻ (aq) → A⁻ (aq) + H₂O (l). Si el ácido y la base son equimolares, el pH de la solución resultante se puede determinar considerando la reacción de equilibrio de A⁻ con agua.
¿Qué diferencias existen entre un ácido fuerte y unácido débil

Los ácidos fuertes son muy pocos, sólo son siete los ácidos fuertes inorgánicos, por lo que para diferenciarlos fácilmente de los débiles se los puede memorizar; si no está en la lista, será un ácido débil. Los ácidos fuertes son el ácido clorhídrico (HCl), el ácido nítrico (HNO 3 ), el ácido sulfúrico (H 2 SO 4 ), el ácido.
CLASIFICACIÓN DE LOS ACIDOS Y BASES POR SU CONDUCTIVIDAD FUERTES Y

El pKa es el logaritmo negativo de Ka, y pKb es el logaritmo negativo de Kb. Los valores de pKa más pequeños indican un ácido fuerte y los valores de pKb más pequeños indican una base fuerte. Los ácidos fuertes incluyen: Ácido clorhídrico (HCl) : pKa -7. Ácido sulfúrico (H 2 SO 4 : pKa -3 a -2.